近日���,同濟大學醫(yī)學院上海東方醫(yī)院腫瘤科化學科學與工程學院石碩教授在納米平臺用于腫瘤聯(lián)合治療的研究方面取得了新的進展�����。相關研究成果已發(fā)表在國際知名期刊《ACS Applied Materials & Interfaces》(IF=9.229���、一區(qū)top期刊)上�����。

△ 圖1
國際知名期刊《ACS Applied Materials & Interfaces》
先前已有實驗將化學動力療法 (CDT) 和光動力療法 (PDT) 整合到一個納米平臺中�����,此種方案可以產生更多的活性氧 (ROS) 用于腫瘤治療�。但是���,如何在腫瘤區(qū)域選擇性地產生足夠的活性氧仍是一個未解決的難點��。
在本研究中,研究人員設計了一種用于腫瘤聯(lián)合治療的的 pH/ROS 響應納米平臺����。酸性微環(huán)境可誘導多柔比星 (DOX) 釋放���,從而通過DNA 損傷誘導腫瘤細胞凋亡���。除此之外,DOX 還可以促進 H2O2的產生����,為CDT提供充足的反應原料�����。
并且,研究人員注意到��,位于核心的上轉換納米粒子可以將980nm的光轉化為紅光和綠光����,分別用于激活二氫卟吩E6(chlorin e6)(Ce6)產生單線態(tài)氧并實現(xiàn)上轉換發(fā)光成像��。然后,ROS反應性連接子雙-(烷硫基)烯烴被1O2裂解��,釋放芬頓計劃(Fenton reagent) (Fe2+)��,實現(xiàn)CDT����。
綜上所述����,F(xiàn)e2+ @UCM-BBD 通過協(xié)同化學/光動力學/化學動力學聯(lián)合治療����,能夠具備按需釋放治療試劑的能力��、優(yōu)異的生物相容性和顯著的腫瘤抑制能力�。
在本研究中����,石碩教授課題組開發(fā)了一種基于UCNP的納米平臺�����,負載DOX、Fenton(Fe2+)和Ce6���,將其命名為Fe2+@UCM-BBD,通過pH/ROS刺激誘導治療藥物特異性釋放����,實現(xiàn)腫瘤特異性PDT/CDT化療協(xié)同治療���。
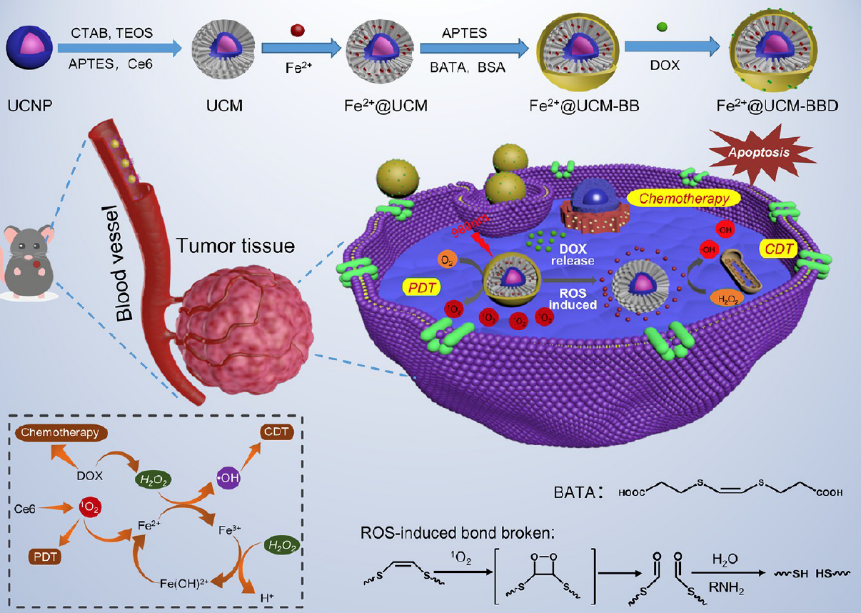
△ 圖2
Fe2+@UCM-BBD 的制備過程和 Fe2+@UCM-BBD 用于化學動力學/光動力學聯(lián)合腫瘤治療示意圖
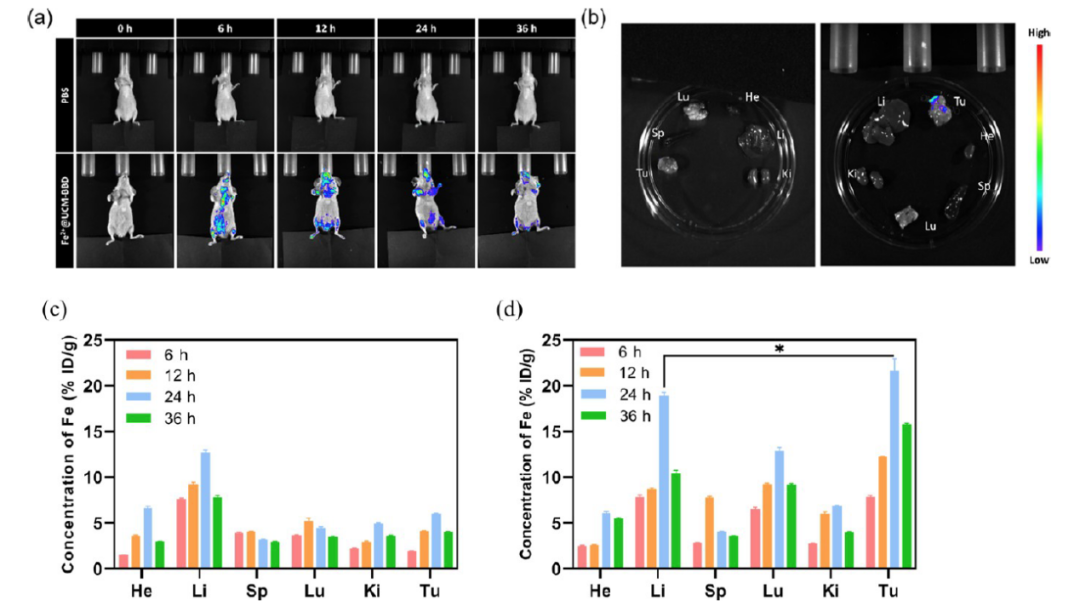
△ 圖3 體內熒光成像
(a) 對照組和Fe2+@UCM-BBD組靜脈給藥后在不同時間點的分布圖
(b) 在36小時處死荷瘤裸鼠后切除的主要器官和腫瘤的熒光成像
(c) PBS組和(d) Fe2+@UCM-BBD組主要組織和腫瘤中Fe的生物分布