近日�����,安徽工業(yè)大學化學與化工學院韓新亞老師團隊在阿爾茨海默疾病的檢測探針開發(fā)研究上取得了新進展���,相關研究成果已經(jīng)發(fā)表在國際權威期刊《Sensors and Actuators B: Chemical》(IF=8.4、一區(qū)期刊)上��。

過氧亞硝酸根(ONOOˉ)是一種具有強氧化和硝化能力的活性氧和氮物種(RONS)��,在生物體系中通過一種快速的擴散控制反應形成��,該反應涉及兩種自由基——一氧化氮(?NO)和超氧陰離子(O2?-)����,且不需要酶催化��。在正常濃度下���,ONOOˉ 能夠維持氧化還原平衡��,并作為信號分子通過硝化酪氨酸殘基來調節(jié)神經(jīng)信號傳導途徑。然而��,ONOOˉ 的過度產(chǎn)生可能導致阿爾茨海默?����。ˋD)中的氧化應激和神經(jīng)退行性變�����,繼而引起脂質����、核酸、酶和蛋白質的結構和功能變化�,這被認為是早期AD診斷的潛在生物標記物���。
當前���,已有多種分析方法被用于檢測ONOOˉ�����,包括電子自旋共振�����、比色法、電化學��、液相色譜-質譜和熒光分析等。其中���,熒光分析檢測方法因其特異性、靈敏度�、非侵入性和實時監(jiān)測的優(yōu)勢而受到廣泛關注,被認為是生物系統(tǒng)中感測和成像ONOOˉ 的理想選擇��。
迄今為止����,許多 ONOOˉ 熒光探針都是依靠不同的反應模式開發(fā)出來的���,例如硫化物的氧化�����、硼酸或硼酸酯的氧化��、C-C雙鍵的斷裂、氧化性N-脫芳基化等����,但ONOOˉ 熒光探針在實際應用中仍存在一些挑戰(zhàn):(1)ONOOˉ 與其質子化形式ONOOH(pKa = 6.8)處于平衡狀態(tài)��,在生物體系中半衰期極短(約10毫秒)��,需要探針具有超快的響應速度以滿足實時監(jiān)測的需求;(2)探針必須具有良好的水溶性和低毒性���,才適合在復雜的生物體系中應用;(3)探針需要對ONOOˉ 具有高度選擇性��,以避免其他ROS/RNS的干擾�����,尤其是與ONOOˉ反應性類似的H?O?;(4)探針應具有大的斯托克斯位移和長波長發(fā)射的特點����,以滿足AD模型中高分辨率和深層成像的需求;(5)在AD大腦中成像ONOOˉ需要探針能夠穿透血腦屏障(BBB)����。
在本研究中,作者設計并合成了兩種新型熒光探針NBD-Y和NBD-I��,它們利用ONOOˉ 氧化斷裂C-N單鍵的能力來感測和成像體外和體內的ONOOˉ。通過對光物理性質的系統(tǒng)研究�,證明NBD-Y和NBD-I具有高靈敏度(檢測限分別為11和45納摩爾)、高水溶性(DMSO/PBS = 1:199, v/v)�����、優(yōu)異的選擇性和對ONOOˉ 的快速響應(3秒內)�。其中,NBD-Y成功在活細胞中可視化ONOOˉ�����,具有良好的細胞膜滲透性和低細胞毒性��。此外����,NBD-Y還可以用于成像AD大腦中的內源性過氧亞硝酸根�,具有良好的BBB穿透性����。這些結果不僅表明NBD-Y作為監(jiān)測過氧亞硝酸根的敏感和可靠探針具有潛力,還可能指導設計用于多個AD模型中ONOOˉ 的新型近紅外�、雙光子和比率熒光探針����。
文中應用了廣州博鷺騰生物科技有限公司AniView多模式動物活體成像系統(tǒng)分別拍攝了小鼠ONOOˉ活體水平和器官水平的熒光成像�。結果顯示�,WT小鼠腦內熒光在0 ~ 1h ( Fmax / F0 = 3.89)內顯著增加���,2 ~ 4h內保持穩(wěn)定�。相比之下��,APP/PS1小鼠組僅觀察到微弱的熒光增強( Fmax / F0 = 1.33 , Fmax和F0分別代表3h和0h時小鼠腦內的熒光強度)。前面體外實驗證實AD組和WT組熒光強度的差異主要是由于探針與被激發(fā)的ONOOˉ之間的反應。三組小鼠的心臟�、肝臟��、脾臟�����、肺和腎臟中幾乎觀察不到熒光,但在其大腦中檢測到明顯的熒光變化���。這些器官的離體成像結果表明�,WT組和姜黃素(CUR)藥物處理組的大腦中的熒光強度遠高于AD組�,證明探針可以穿過血腦屏障并在大腦中檢測到ONOOˉ�����。這些結果證明ONOOˉ的過度表達是阿爾茨海默病的明顯標志�����,并且NBD-Y可以有效地檢測大腦中ONOOˉ的表達水平��。
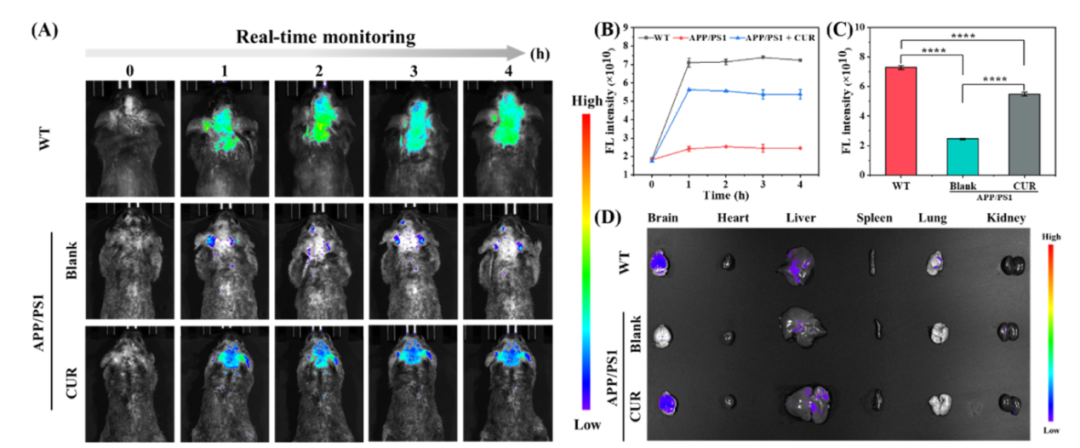
小鼠ONOOˉ活體水平的熒光成像
( A ) 通過尾靜脈注射200 μL 0.2mM NBD-Y���,在WT�、AD以及CUR處理的AD小鼠腦內進行ONOOˉ的活體熒光成像
( B ) 圖( A )中小鼠在體熒光強度隨時間變化圖
( C ) 三組3h熒光強度比較��。* * * * P < 0.0001
( D ) 對WT��、AD以及CUR處理的AD小鼠的大腦和主要器官進行熒光成像�����。數(shù)據(jù)以平均值± SD表示�,λex = 435 ~ 495nm,λem = 520 ~ 560nm

論文鏈接:https://doi.org/10.1016/j.snb.2024.135739